Attached files
| file | filename |
|---|---|
| 8-K - 8-K - YUMANITY THERAPEUTICS, INC. | d260754d8k.htm |
Exhibit 99.1
|
|
Proteostasis Therapeutics
(Nasdaq: PTI)
Investor Presentation
August 2016
|
|
Disclaimer
This presentation includes forward looking statements. All statements contained in this presentation other than statements of historical facts, including statements regarding future results of operations and financial position of PTI, our business strategy and plans and our objectives for future operations, are forward looking statements. Although we believe that the expectations reflected in these forward looking statements are reasonable, these statements relate to our strategy, future operations, future financial position, future revenue, projected costs, prospects, plans, objectives of management and expected market growth, and involve known and unknown risks, uncertainties and other factors that may cause our actual results, levels of activity, performance or achievements to be materially different from any future results, levels of activity, performance or achievements expressed or implied by these forward looking statements.
This presentation also contains estimates and other statistical data made by independent parties and by us relating to disease incidence, market size and other data about our industry. This data involves a number of assumptions and limitations, and you are cautioned not to give undue weight to such estimates. Projections, assumptions and estimates of our future performance and the future performance of the markets in which we operate are necessarily subject to a high degree of uncertainty and risk. New risks emerge from time to time, and except as required by law, neither we nor any other person makes any representation as to the accuracy or completeness of such data or undertakes any obligation to update such data after the date of this presentation. You should, therefore, not rely on these forward looking statements as representing our views as of any date subsequent to the date of this presentation. By attending or receiving this presentation you acknowledge that you will be solely responsible for your own assessment of the market and our market position and that you will conduct your own analysis and are solely responsible for forming your own view of the potential future performance of our business.
The trademarks included herein are the property of the owners thereof and are used for reference purposes only. Such use should not be construed as an endorsement of the Company or this proposed offering.
2
|
|
Investment Highlights
Proprietary platform for addressing diseases caused by dysfunctional protein processing Initial focus on increasing CFTR activity in patients with Cystic Fibrosis (CF) Developing a novel class of amplifiers (PTI 428) that increase CFTR protein levels Developing novel combination therapy (PTI NC 733) for the treatment of CF
Additional upside from Biogen and Astellas collaborations for other protein processing diseases
3
|
|
Company Overview
Located in Cambridge, MA with more than 50 employees and growing
Founded in 2006 to take advantage of insights into the Proteostasis Network
Breakthrough discovery in 2013: PTI discovers a new class of CFTR modulators termed “Amplifiers” that increase the level of CFTR protein across all CF genotype classes First time in CF drug development for a CFTR modulator to potentially deliver efficacy across almost all CF patient classes and almost double the efficacy of Orkambi and Kalydeco Allows for the development of a clinical biomarker that may be predictive of clinical efficacy Amplifiers also used as a screening tool to identify synergistic and proprietary corrector and potentiator that, together with the amplifier, constitute PTI’s triple combination (PTI NC 733) PTI NC 733 is the only triple combination treatment in development that could restore CFTR activity to ~100% based on an in vitro efficacy model which may translate to an FEV1 lung function improvement of ~20% IPO February 2016: Raised $50 million to accelerate preclinical and clinical programs
4
|
|
Key Developments in CF Pipeline Programs
PTI 428: Preliminary data from ongoing Phase 1 studies supports expected activity and safety
Biomarker measurement confirms target engagement after single administration of PTI 428 Dose dependent relationship between PTI 428 exposure and the magnitude of CFTR mRNA increase in nasal epithelia of healthy volunteers No safety concerns to date
PTI NC 733: Triple combination achieves almost full restoration of CFTR activity in vitro
Triple combination containing PTI 428 works to restore CFTR activity in vitro in CF patient derived cells PTI 801 corrector and PTI 808 potentiator currently on track for IND submission by end of 2016
5
|
|
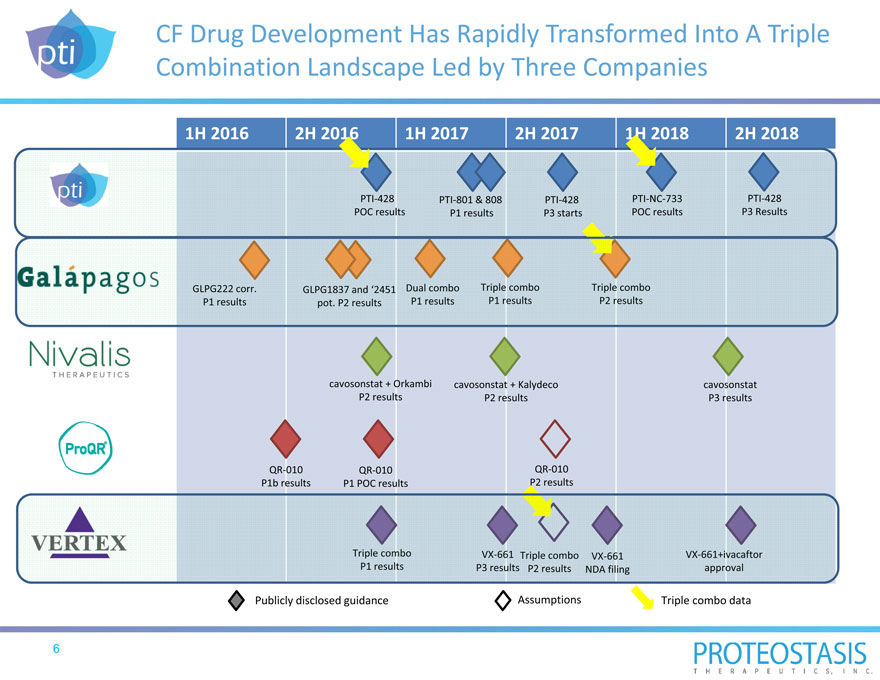
CF Drug Development Has Rapidly Transformed Into A Triple Combination Landscape Led by Three Companies
1H 2016 2H 2016 1H 2017 2H 2017 1H 2018 2H 2018
PTI 428 PTI 801 & 808 PTI 428 PTI NC 733 PTI 428
POC results P1 results P3 starts POC results P3 Results
cavosonstat + Orkambi cavosonstat + Kalydeco cavosonstat
P2 results P2 results P3 results
QR 010 QR 010 QR 010
P1b results P1 POC results P2 results
Publicly disclosed guidance Assumptions Triple combo data
6
|
|
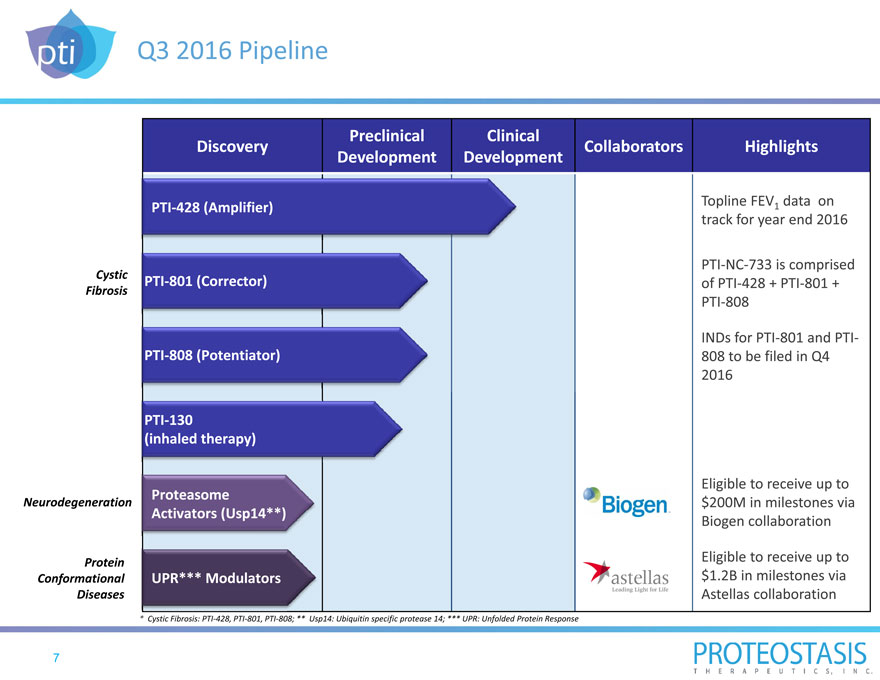
Q3 2016 Pipeline
Preclinical Clinical
Discovery Collaborators Highlights
Development Development
PTI 428 (Amplifier) Topline FEV1 data on
track for year end 2016
PTI NC 733 is comprised
Cystic PTI 801 (Corrector) of PTI 428 + PTI 801 +
Fibrosis
PTI 808
INDs for PTI 801 and PTI
PTI 808 (Potentiator) 808 to be filed in Q4
2016
PTI 130
(inhaled therapy)
Eligible to receive up to
Proteasome
Neurodegeneration $200M in milestones via
Activators (Usp14**) Biogen collaboration
Protein Eligible to receive up to
Conformational UPR*** Modulators $1.2B in milestones via
Diseases Astellas collaboration
* Cystic Fibrosis: PTI 428, PTI 801, PTI 808; ** Usp14: Ubiquitin specific protease 14; *** UPR: Unfolded Protein Response
7
|
|
Cystic Fibrosis is One of the Most Common Life Limiting Genetic Diseases with No Known Cure
70,000 to 100,000: affected globally with the majority in the US, Canada, Europe and Australia
29 years: median age of death in US
Progressive disease caused by a mutated CFTR gene: results in defective CFTR protein production and function and a dysregulation
of ion flow at the epithelial cell surface
Results: buildup of mucus in lungs, pancreas and gastrointestinal tract
Vast majority of patients die of respiratory failure
Therapeutic approach: revolutionized with the advent of CFTR modulators such as Kalydeco® and Orkambi®
Hospitalized CF patient recovering from an exacerbation getting ready to be discharged with his chronic palliative treatment. Today,
CFTR modulators offer a new treatment paradigm to slow disease progression.
8
|
|
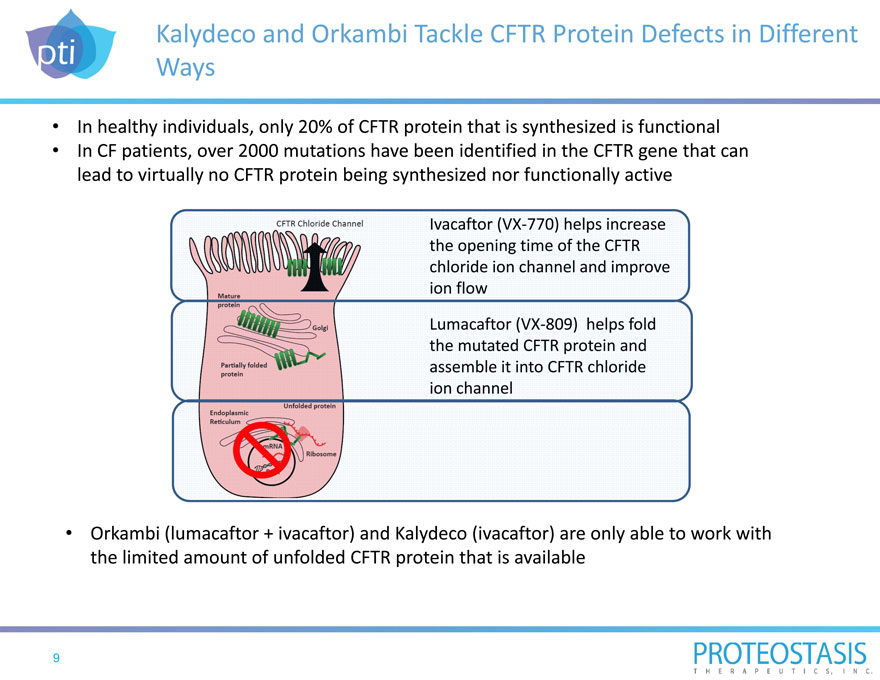
Kalydeco and Orkambi Tackle CFTR Protein Defects in Different Ways
In healthy individuals, only 20% of CFTR protein that is synthesized is functional In CF patients, over 2000 mutations have been
identified in the CFTR gene that can lead to virtually no CFTR protein being synthesized nor functionally active
Orkambi (lumacaftor + ivacaftor) and Kalydeco (ivacaftor) are only able to work with the limited amount of unfolded CFTR protein that is available
9
|
|
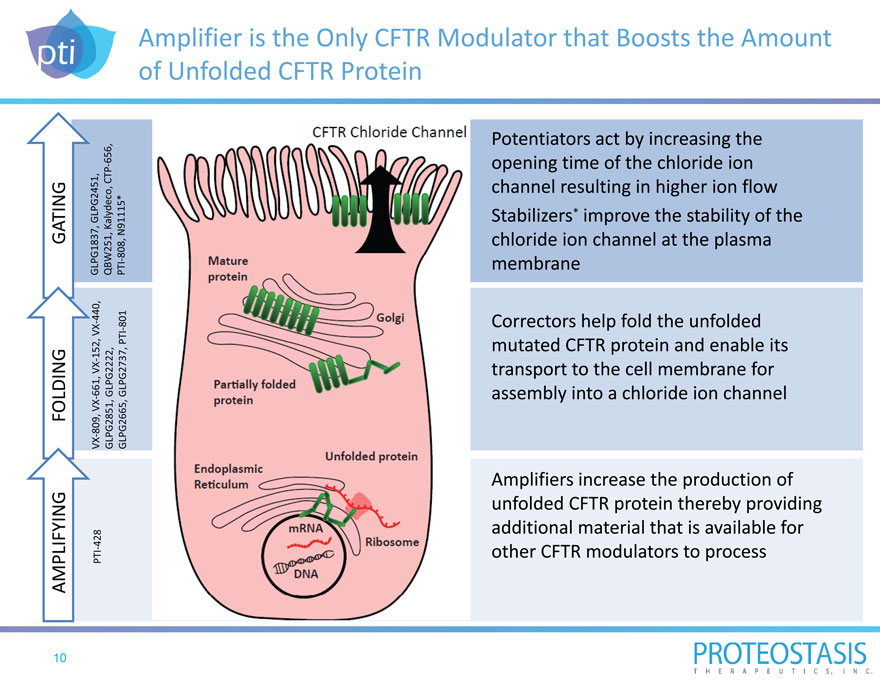
Amplifier is the Only CFTR Modulator that Boosts the Amount of Unfolded CFTR Protein
AMPLIFYING FOLDING GATING
PTI 428 VX 80 9, VX 661, VX 152, VX 440, GLPG1837, GLPG2451,
GLPG2851, GLPG2222, QBW251, Kalydeco, CT P 656, GLPG2665, GLPG2737, P TI 801 PTI 808, N91115*
Potentiators act by increasing the opening time of the chloride ion channel resulting in higher ion flow Stabilizers* improve the stability of the chloride ion channel at the plasma membrane
Correctors help fold the unfolded mutated CFTR protein and enable its transport to the cell membrane for assembly into a chloride
ion channel
Amplifiers increase the production of unfolded CFTR protein thereby providing additional material that is available for other CFTR
modulators to process
10
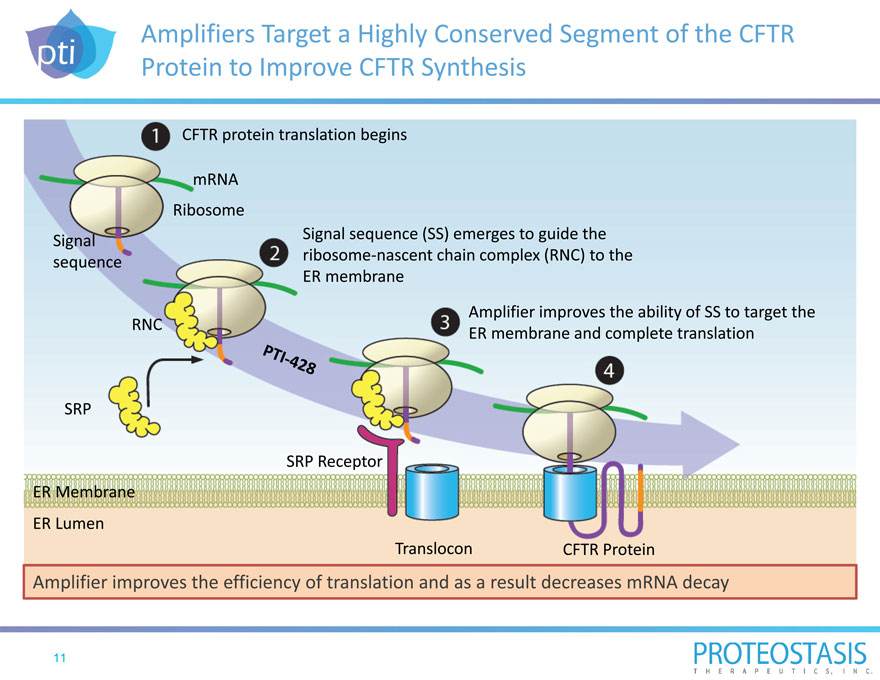
Amplifiers Target a Highly Conserved Segment of the CFTR Protein to Improve CFTR Synthesis
CFTR protein translation begins
mRNA Ribosome
Signal
sequence
Signal sequence (SS) emerges to guide the ribosome nascent chain complex (RNC) to the ER membrane
Amplifier improves the ability of SS to target the ER membrane and complete translation
RNC SRP
SRP Receptor
ER Membrane
ER Lumen
Translocon CFTR Protein
Amplifier improves the efficiency of translation and as a result decreases mRNA decay
11

Measurement of CFTR Protein Activity In Vitro is Highly Correlated with Clinical Efficacy
Severity of CF progression is measured by FEV1 (forced expiratory volume in one second) in patients
CFTR modulators are evaluated in Ussing Chamber Assay
Potentiator and correctors show a strong correlation between their effect in vitro measured by the Ussing Chamber Assay and lung function improvement
FEV1 is industry standard efficacy endpoint in CF clinical trials Rate of FEV1 decline correlates with life expectancy and is predictive of mortality
In vitro CFTR protein activity is measured in human bronchial epithelial (HBE) cells derived from the lungs of CF patients
Ussing Chamber Assay invented in 1946 and well established in CF basic research
In vitro activity of CFTR protein expressed as 50% of normal CFTR function correlates with an absolute FEV1 improvement of approximately 10% observed in clinical trials
12
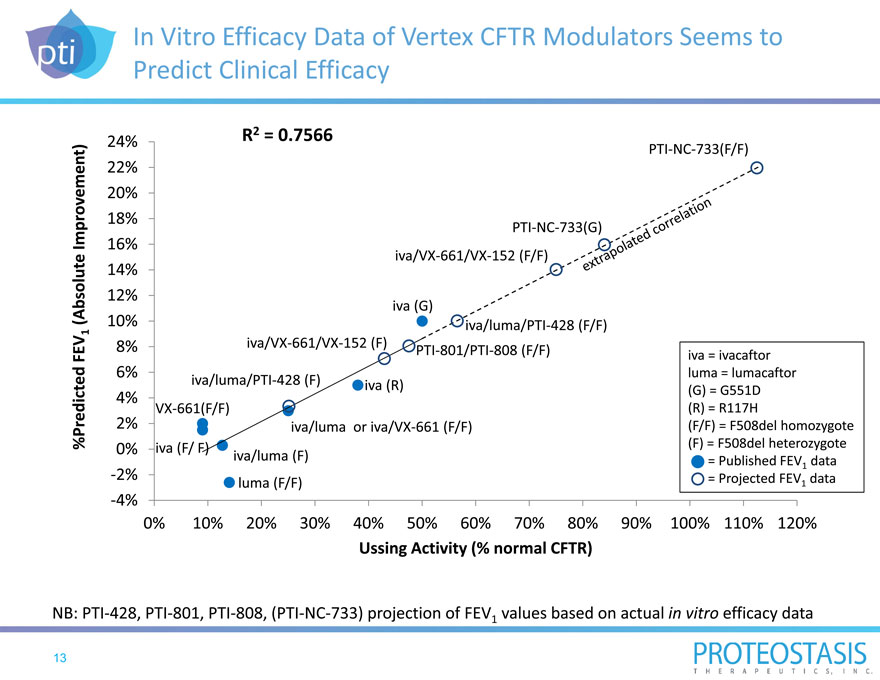
In Vitro Efficacy Data of Vertex CFTR Modulators Seems to Predict Clinical Efficacy
%P redicted FEV1 Improvem(Absolute ent)
NB: PTI 428, PTI 801, PTI 808, (PTI NC 733) projection of FEV1
24% R2 = 0.7566
PTI NC 733(F/F)
22%
20%
18% PTI NC 733(G)
16%
iva/VX 661/VX 152 (F/F)
14%
12%
iva (G)
10% iva/luma/PTI 428 (F/F)
8% iva/VX 661/VX 152 (F) PTI 801/PTI 808 (F/F) iva = ivacaftor
6% luma = lumacaftor
iva/luma/PTI 428 (F) iva (R)
4% (G) = G551D
VX 661(F/F) (R) = R117H
2% iva/luma or iva/VX 661 (F/F) (F/F) = F508del homozygote
0% iva (F/ F) (F) = F508del heterozygote
iva/luma (F) = Published FEV data
1
2% luma (F/F) = Projected FEV1 data
4%
0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100% 110% 120%
Ussing Activity (% normal CFTR)
values based on actual in vitro efficacy data
13
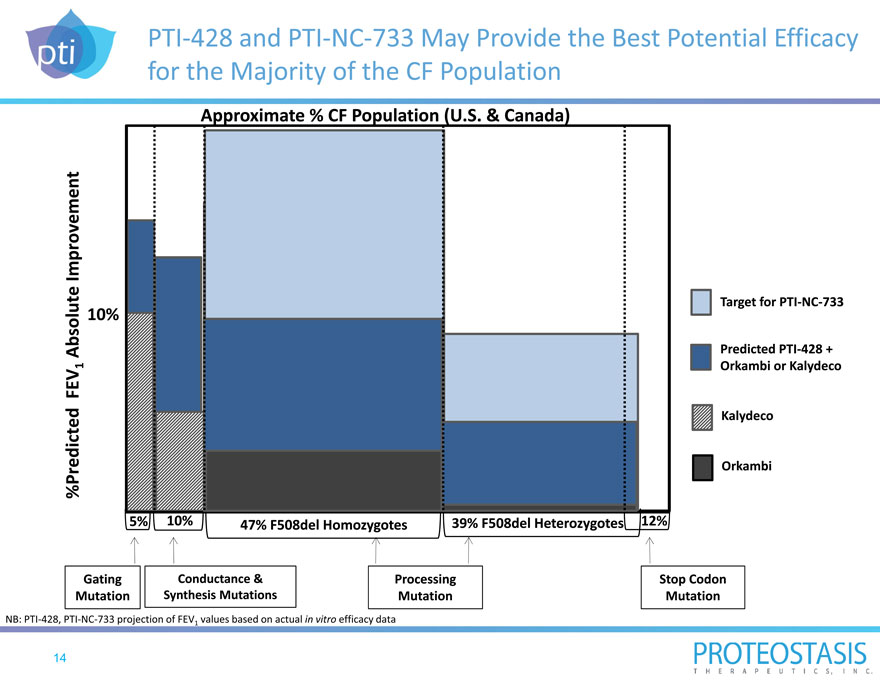
PTI 428 and PTI NC 733 May Provide the Best Potential Efficacy for the Majority of the CF Population
Approximate % CF Population (U.S. & Canada)
rovement
Imp
solute
Target for PTI NC 733
10%
Ab Predicted PTI 428 +
| 1 |
|
Orkambi or Kalydeco |
FEV
ed
Kalydeco
%Predict Orkambi
5% 10% 47% F508del Homozygotes 39% F508del Heterozygotes 12%
Gating Conductance & Processing Stop Codon
Mutation Synthesis Mutations Mutation Mutation
NB: PTI 428, PTI NC 733 projection of FEV1 values based on actual in vitro efficacy data
14
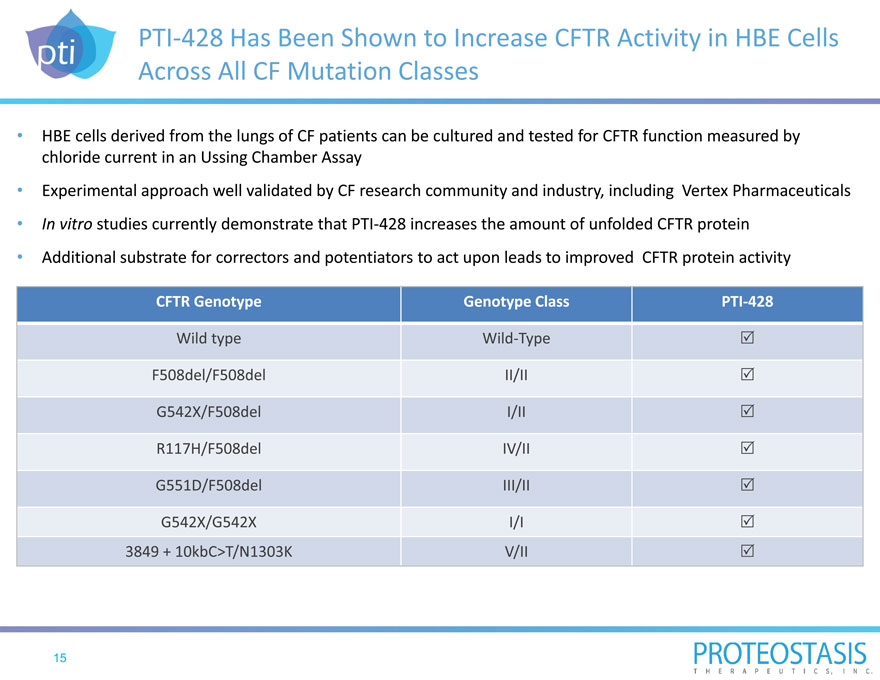
PTI 428 Has Been Shown to Increase CFTR Activity in HBE Cells Across All CF Mutation Classes
HBE cells derived from the lungs of CF patients can be cultured and tested for CFTR function measured by chloride current in an Ussing Chamber Assay
Experimental approach well validated by CF research community and industry, including Vertex Pharmaceuticals In vitro studies currently demonstrate that PTI 428 increases the amount of unfolded CFTR protein Additional substrate for correctors and potentiators to act upon leads to improved CFTR protein activity
CFTR Genotype Genotype Class PTI 428
Wild type Wild Type F508del/F508del II/II G542X/F508del I/II R117H/F508del IV/II G551D/F508del III/II
G542X/G542X I/I 3849 + 10kbC>T/N1303K V/II
15
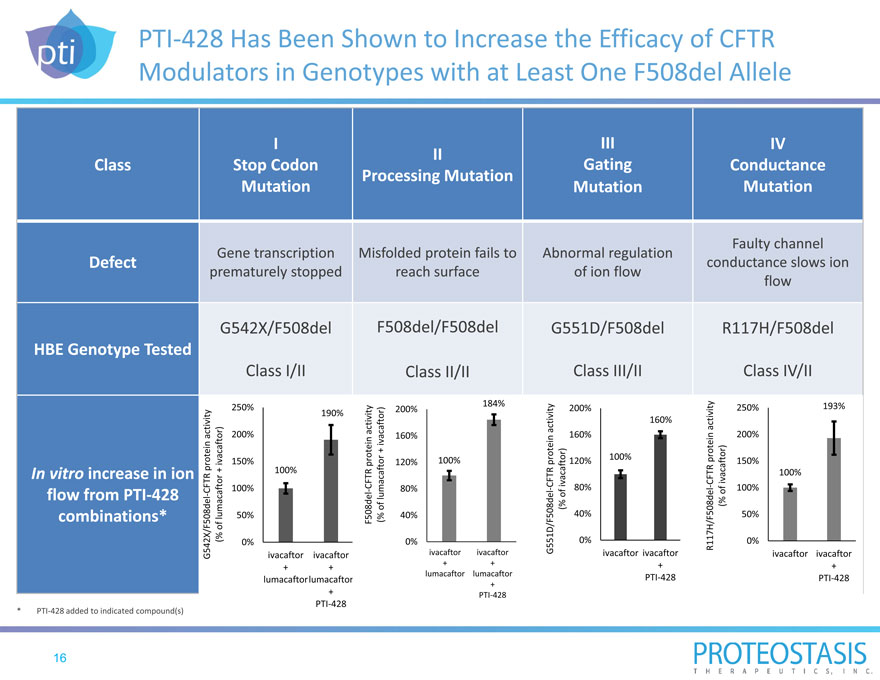
PTI 428 Has Been Shown to Increase the Efficacy of CFTR Modulators in Genotypes with at Least One F508del Allele
I III IV
II
Class Stop Codon Gating Conductance
Processing Mutation
Mutation Mutation Mutation
Faulty channel
Gene transcription Misfolded protein fails to Abnormal regulation
Defect conductance slows ion
prematurely stopped reach surface of ion flow
flow
G542X/F508del F508del/F508del G551D/F508del R117H/F508del
HBE Genotype Tested
Class I/II Class II/II Class III/II Class IV/II
250% 200% 184% 200% 250% 193%
190%
vity tivity ftor) tivity 160% ctivity
ac ac a
acti
200% ivaca 160% 160% 200%
+
100%
150% 120% 100% 120% CFTR 150%
CFTR
protein + ivacaftor) CFTR protein protein protein
CFTR
In vitro increase in ion macaftor 100% 100%
ivacaftor)
ivacaftor)
08del
80% 8del 80% 100%
8del
del
(%
(%
flow from PTI 428 100% lumacaftor of of
of
(%
combinations* lu 50% F50 40% 40% 50%
0% 0% 0% 0%
G542X/F508 ivacaftor ivacaftor ivacaftor ivacaftor G551D/F50 ivacaftor ivacaftor R117H/F5 ivacaftor ivacaftor
+ + + + + +
lumacaftor lumacaftor lumacaftor lumacaftor PTI 428 PTI 428
+
+ PTI 428
PTI 428
| * |
|
PTI 428 added to indicated compound(s) |
16
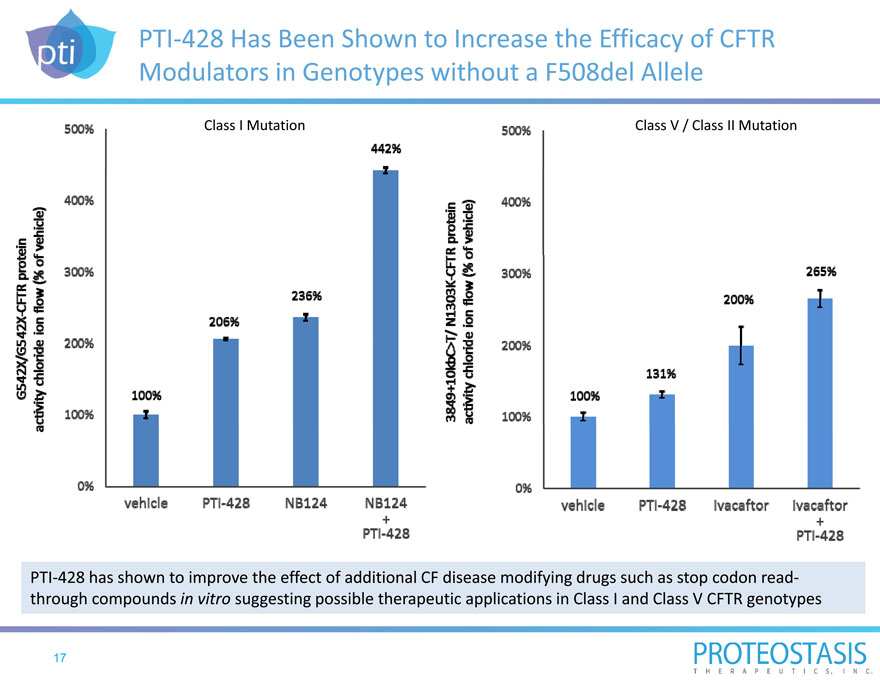
PTI 428 Has Been Shown to Increase the Efficacy of CFTR Modulators in Genotypes without a F508del Allele
Class I Mutation
Class V / Class II Mutation
PTI 428 has shown to improve the effect of additional CF disease modifying drugs such as stop codon read through compounds in vitro suggesting possible therapeutic applications in Class I and Class V CFTR genotypes
17
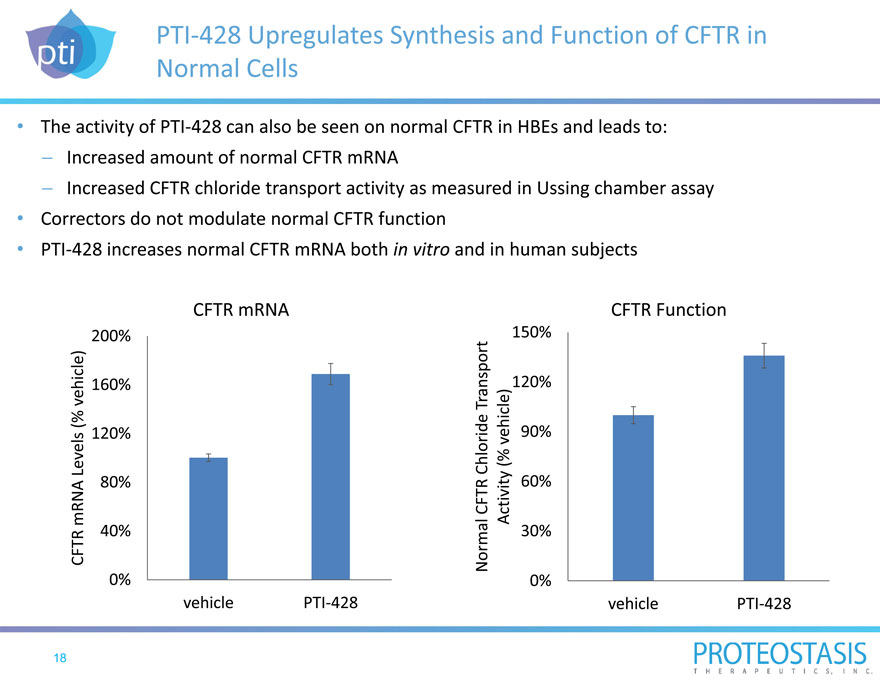
PTI 428 Upregulates Synthesis and Function of CFTR in Normal Cells
The activity of PTI 428 can also be seen on normal CFTR in HBEs and leads to: Increased amount of normal CFTR mRNA
Increased CFTR chloride transport activity as measured in Ussing chamber assay Correctors do not modulate normal CFTR function PTI 428 increases normal CFTR mRNA both in vitro and in human subjects
CFTR mRNA
200%
160%
vehicle)
%
(
Levels 120%
RNA 80%
m
CFTR 40%
0%
vehicle PTI 428
CFTR Function
150%
120%
Transport
e hicle)
90%
ve
(%
Chlorid
FTR tivity 60%
C
Normal Ac
30%
0%
vehicle PTI 428
18

Detection and Measurement of CFTR mRNA and Protein Developed as a Clinical Biomarker
Amplifiers are the only known CFTR modulators that lead to an increase in unfolded CFTR protein which results in a decrease in mRNA decay. Thus, a clinical biomarker was designed to detect an increase in CFTR mRNA and protein
Clinical Biomarker Development
expression measurable in nasal expression measured in nasal increase with PTI 428 in both normal epithelial cells of rats, monkeys epithelial cells with PTI 428 in and CF patient HBE cells
NHV and CF patients Phase 1 NHV and CF subjects
Nasal Brushing Protocol
Repeat
ASI Rhino brushing Pre
Pro Curettes X3 motion at prepared
least 3 times lysis buffer
Store @ 80°C
immediately Retain the tip of Repeat
and ship to curettes in the with the
analysis lab same Eppendorf other
on dry ice tube nostril
19
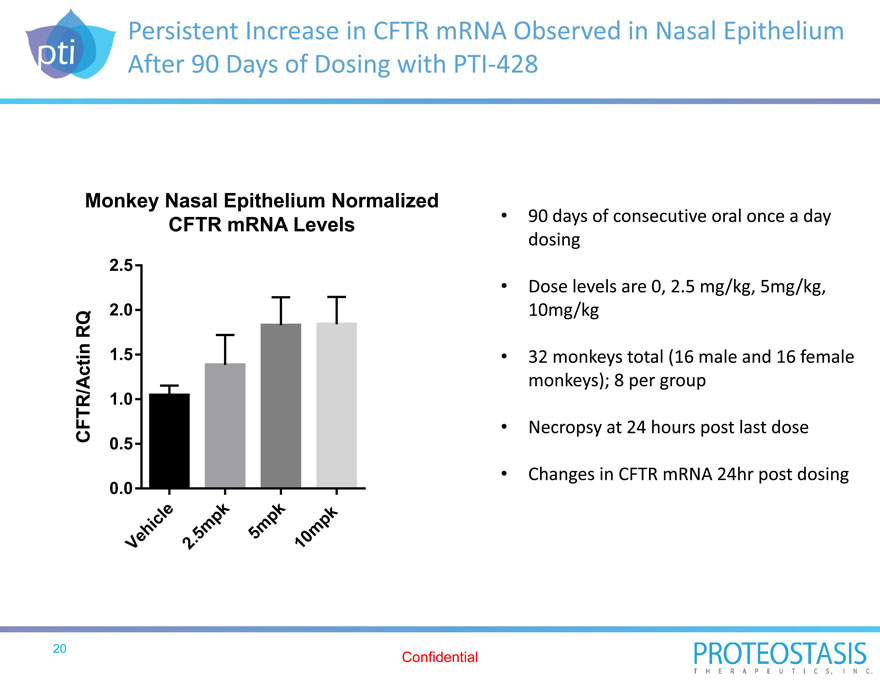
Persistent Increase in CFTR mRNA Observed in Nasal Epithelium After 90 Days of Dosing with PTI 428
Monkey Nasal Epithelium Normalized
CFTR mRNA Levels
2.5
RQ 2.0
1.5
FTR/Actin 1.0
C 0.5
0.0
l e k k k
hi c m p 5m p mp
Ve 2 . 5 1 0
90 days of consecutive oral once a day dosing
Dose levels are 0, 2.5 mg/kg, 5mg/kg, 10mg/kg
32 monkeys total (16 male and 16 female monkeys); 8 per group
Necropsy at 24 hours post last dose
Changes in CFTR mRNA 24hr post dosing
Confidential
20
|
|
PTI 428 Animal Safety Studies Support Daily Administration in the Clinic
Safety profile of PTI 428 supports advancing clinical development
Adverse events included monitorable and reversible decrease in platelets which occurred at higher exposures than intended for humans
Preclinical data provide support for human clinical trials with duration of up to 12 weeks
Safety, tolerability and exposure of PTI 428 were confirmed in dose ranging studies in rodents and monkeys under GLP conditions for up to 90 days of oral administration
In rats, the most sensitive species, established a > 14 fold safety margin compared with the starting dose to be tested in subjects with CF
Decrease in platelets observed at supra therapeutic doses in 28 day GLP studies
In 90 day GLP studies in rat and monkey, no significant signs, such as changes in bodyweight, food consumption, blood counts and serum chemistry were observed
Long term toxicity studies will be completed prior to initiation of our Phase 3 program
21
|
|
PTI 428 Phase 1 Trials Ongoing and Studies Running in Parallel
PTI 428 01 CF
Safety study and also designed to include proof of concept
Eligible subjects include males and females with CF, 18 55 years, FEV1 > 50% predicted, all genotypes
Single Ascending Dose (SAD) portion to test 3 oral, daily, dose levels starting with 10mg
Multiple Ascending Dose (MAD) portion to test 3 oral, daily, dose levels starting with 20mg for 7 days
Primary endpoints are safety, tolerability and PK, and exploratory endpoints are CFTR mRNA from nasal brushings, sweat chloride and FEV1 changes
| • |
|
Proof –of Concept cohorts (4:1 randomization) include subjects on Orkambi. Cohort estimated to have 20 subjects and will be dosed for at least 14 days. On track to initiate dosing in Q4 2016 |
PTI 428 02 NHV
Study designed to asses DDI potential of PTI 428 with oral contraceptives and also includes a SAD and MAD portion In vitro profile suggests low risk of PTI 428 interacting with oral contraceptives and if confirmed clinically, contraception requirement may be lessened in future clinical studies and improve patient recruitment SAD and MAD portions to test same 3 dose levels as PTI 428 01 study and select a single dose for DDI portion
Primary endpoints are safety, tolerability and PK, and exploratory endpoints are CFTR mRNA from nasal brushings
SAD and MAD dosing on track to complete in Q3 2016
22
|
|
PTI 428 Phase 1 Update
Study PTI 428 02 HV DDI Study
Dosing completed in Single Ascending Dose up to 100 mg (n=24)
Safety Review Committee has not identified any safety concerns based on reviews of vital signs, clinical exams, ECG, chemistry and hematology lab values Multiple Ascending Dose initiated with 20 mg/day cohort Preliminary exploratory biomarker nasal CFTR mRNA data confirm target engagement and enable dose selection for the proof of concept study in CF subjects CFTR mRNA biomarker analysis is robust with no assay failures observed to date Approximately a 2 fold increase in CFTR mRNA observed in subjects where PTI 428 achieved a threshold concentration Preliminary PK data show dose proportionality up to 100 mg and support once daily dosing
Study PTI 428 01 CF Study
Plan to target 20 sites by Q4 across North America and Europe Dosing in SAD and MAD cohorts currently on track to complete in Q4 Proof of concept in subjects on Orkambi to initiate in Q4
23
|
|
PTI 428 Phase 2 Dose Range Finding Study Overview
Phase 2 Dose Range Study in CF Subjects on Orkambi
Approximately 90 subjects 3 dose groups Dosing to initiate in Q1 2017
Dose selection will consider biomarker data from Phase 1 studies
Key endpoints will include FEV1, CFQ R, weight and pulmonary exacerbation 3 month study to capture CFQ R, weight and pulmonary exacerbation endpoints Interim analysis at 1 month to select a Phase 3 dose based on FEV1 changes
24
|
|
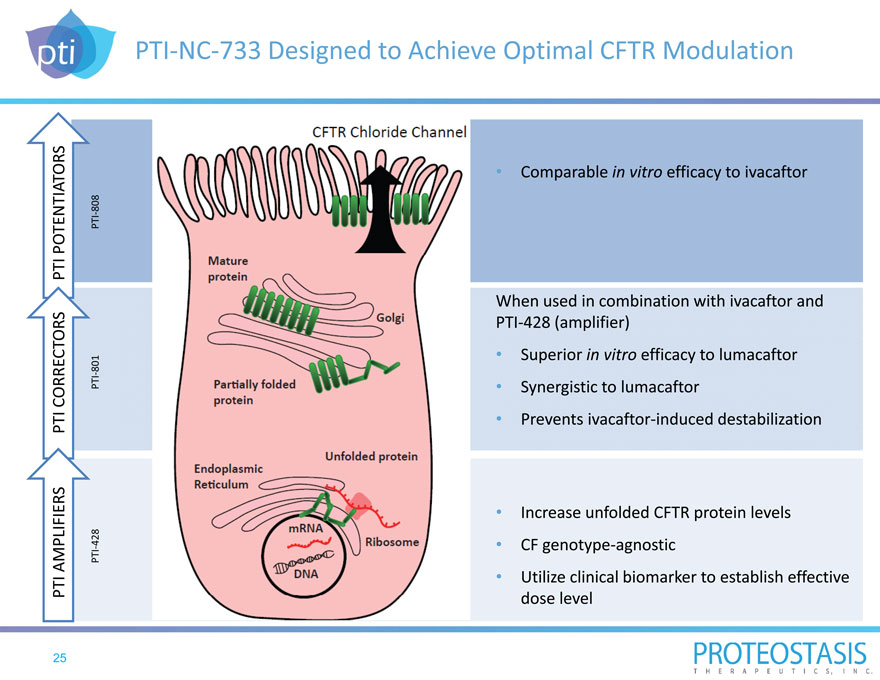
PTI NC 733 Designed to Achieve Optimal CFTR Modulation
PTI AMPLIFIERS P TI CORRECTORS PTI POTENTIATORS
PTI 428 PTI 801 PTI 808
Comparable in vitro efficacy to ivacaftor
When used in combination with ivacaftor and PTI 428 (amplifier)
Superior in vitro efficacy to lumacaftor
Synergistic to lumacaftor
Prevents ivacaftor induced destabilization
Increase unfolded CFTR protein levels
CF genotype agnostic
Utilize clinical biomarker to establish effective dose level
25
|
|
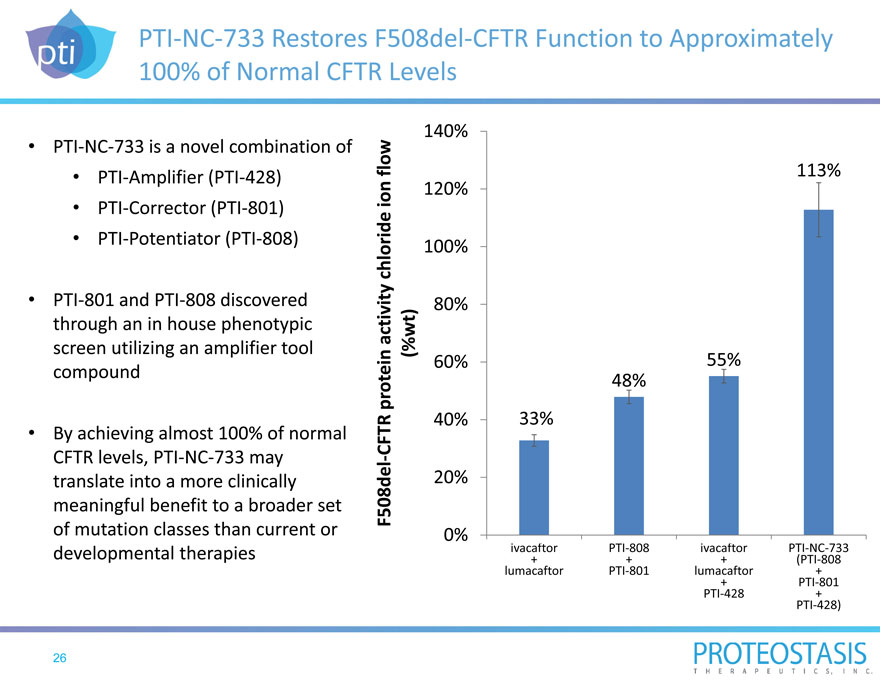
PTI NC 733 Restores F508del CFTR Function to Approximately 100% of Normal CFTR Levels
PTI NC 733 is a novel combination of
| • |
|
PTI Amplifier (PTI 428) |
| • |
|
PTI Corrector (PTI 801) |
| • |
|
PTI Potentiator (PTI 808) |
PTI 801 and PTI 808 discovered through an in house phenotypic screen utilizing an amplifier tool compound
By achieving almost 100% of normal CFTR levels, PTI NC 733 may translate into a more clinically meaningful benefit to a broader set of mutation classes than current or developmental therapies
F508del CFTR protein a ctivity chl oride ion flow (%wt)
140%
113%
120%
100%
80%
60% 55%
48%
40% 33%
20%
0%
ivacaftor PTI 808 ivacaftor PTI NC 733
+ + + (PTI 808
lumacaftor PTI 801 lumacaftor +
+ PTI 801
PTI 428 +
PTI 428)
26
|
|
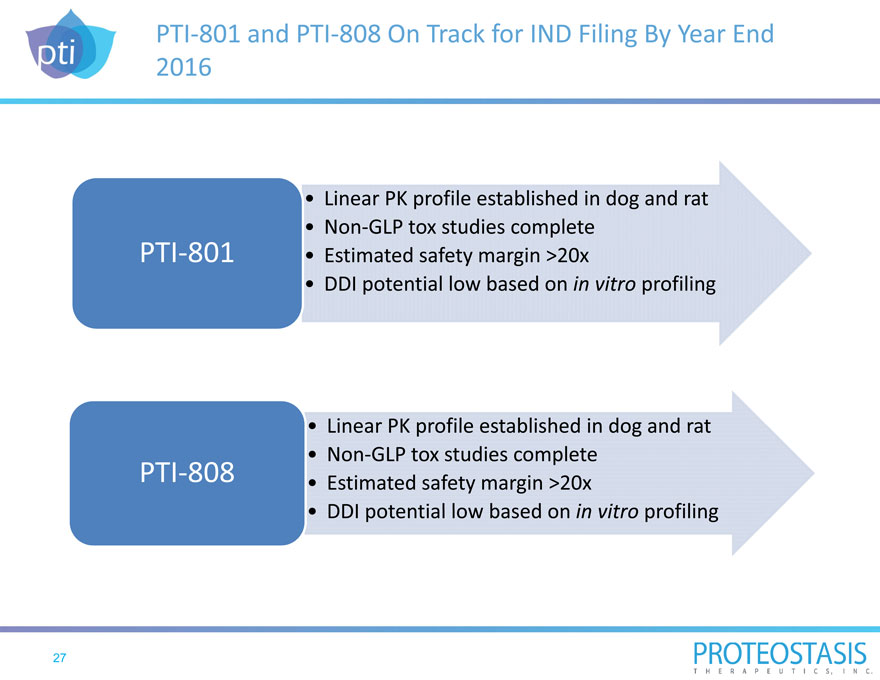
PTI 801 and PTI 808 On Track for IND Filing By Year End 2016
| • |
|
Linear PK profile established in dog and rat |
| • |
|
Non GLP tox studies complete |
PTI 801
| • |
|
DDI potential low based on in vitro profiling |
| • |
|
Non GLP tox studies complete PTI 808 Estimated safety margin >20x |
| • |
|
DDI potential low based on in vitro profiling |
27
|
|
Unique Features of PTI CF Product Candidates Allow for Differentiated Clinical Development Strategy
Limited availability and eligibility of CF patients for investigational clinical trials can negatively impact study duration and costs
Differentiated profile of PTI drug candidates allows for a unique clinical development strategy that could circumvent potential pitfalls faced by other investigational drugs
Approximately 1 out of 2 CF patients are eligible for approved disease modifying drugs (Orkambi, Kalydeco) in the US and thus not likely to participate in clinical trials that require treatment suspension
Approximately 1 out of 6 patients are being targeted by currently ongoing clinical studies in the US
PTI 428
Phase 1 study will be performed in CF patients on as come basis regardless of CFTR genotype Proof of concept and dose range finding studies will be conducted in patients already on standard of care (Orkambi, Kalydeco) and all patients will receive marketed drugs
PTI NC 733
The combination of the corrector and potentiator in PTI NC 733 has demonstrated superior in vitro efficacy compared to the combination of lumacaftor and ivacaftor
28
|
|
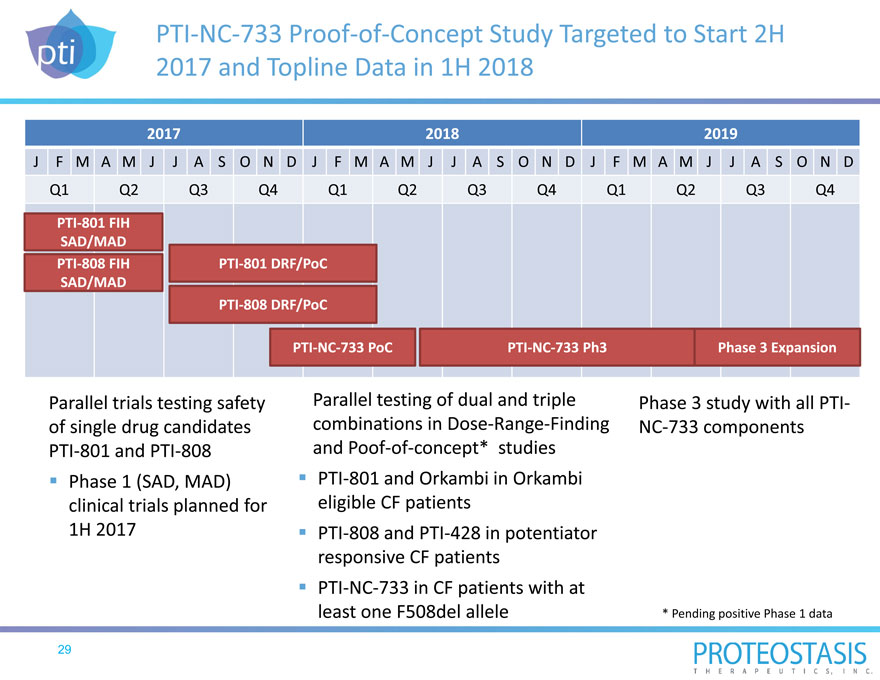
PTI NC 733 Proof of Concept Study Targeted to Start 2H 2017 and Topline Data in 1H 2018
2017 2018 2019
J F M A MJ J A S O N D J F M A MJ J A S O N D J F M A MJ J A S O N D Q1 Q2 Q3 Q4 Q1 Q2 Q3 Q4 Q1 Q2 Q3 Q4
PTI 801 FIH SAD/MAD
PTI 808 FIH PTI 801 DRF/PoC SAD/MAD
PTI 808 DRF/PoC
PTI NC 733 PoC PTI NC 733 Ph3 Phase 3 Expansion
Parallel trials testing safety of single drug candidates PTI 801 and PTI 808 Phase 1 (SAD, MAD) clinical trials planned for
1H 2017
Parallel testing of dual and triple combinations in Dose Range Finding and Poof of concept* studies PTI 801 and Orkambi in Orkambi eligible CF patients PTI 808 and PTI 428 in potentiator responsive CF patients PTI NC 733 in CF patients with at least one F508del allele
Phase 3 study with all PTI NC 733 components
* Pending positive Phase 1 data
29
|
|
Key Upcoming Milestones
Q4 2016: PTI 428 Proof of concept study initiated in CF patients
Q4 2016: PTI 428 Topline proof of concept data including key secondary endpoint of efficacy as measured by FEV1 Q4 2016: PTI 801 and PTI 808 IND Filing
1H 2017: PTI 428 Phase 2 Dose Range Finding Study initiation (90 days of dosing)
1H 2017: PTI 428 Phase 2 Topline data from Dose Range Finding Study
1H 2017: PTI NC 733 Phase 1 initiation in NHV
1H 2017: PTI NC 733 Phase 1 Topline data
2H 2017: PTI NC 733 Phase 2 initiation
1H 2018: PTI NC 733 Phase 2 Topline data*
* If PTI 428 Phase 1 trial is successful
30
|
|
Investment Highlights
Proprietary platform for addressing diseases caused by dysfunctional protein processing Initial focus on increasing CFTR activity in patients with Cystic Fibrosis (CF) Developing a novel class of amplifiers (PTI 428) that increase CFTR protein levels Developing novel combination therapy (PTI NC 733) for the treatment of CF
Additional upside from Biogen and Astellas collaborations for other protein processing diseases
31
|
|
Appendix
32
|
|
Management Team and Board
Management Team Board Members
Meenu Chhabra *
M. James Barrett, Ph.D. President & CEO
Po?Shun Lee, M.D. Executive Vice President
Eric Rabinowitz CMO
Jim DeTore CFO
Franklin M. Berger FMB Research
Geoff Gilmartin, M.D. Jeffery Kelly, Ph.D. CDO
Benito Munoz, Ph.D.
Christopher T. Walsh, Ph.D. Senior Vice President Head of Drug Discovery
Marija Zecevic, Ph.D.
Helen M. Boudreau Vice President Business Development
| * |
|
Management Team & Director |
33
|
|
CF Clinical Advisory Board
Clinical Advisory Board Members
Richard Moss, M.D. ? Chair Felix Ratjen, M.D., Ph.D.
Jane Davies, M.D. Isabelle Sermet?Gaudelus, M.D., Ph.D.
Pamela Zeitlin, M.D., Ph.D
Michael Knowles, M.D
34
|
|
Proteostasis Therapeutics
(Nasdaq: PTI)
Investor Presentation
August 2016