Attached files
| file | filename |
|---|---|
| 8-K/A - 8-K/A - Aravive, Inc. | d885609d8ka.htm |
| Exhibit 99.1
|
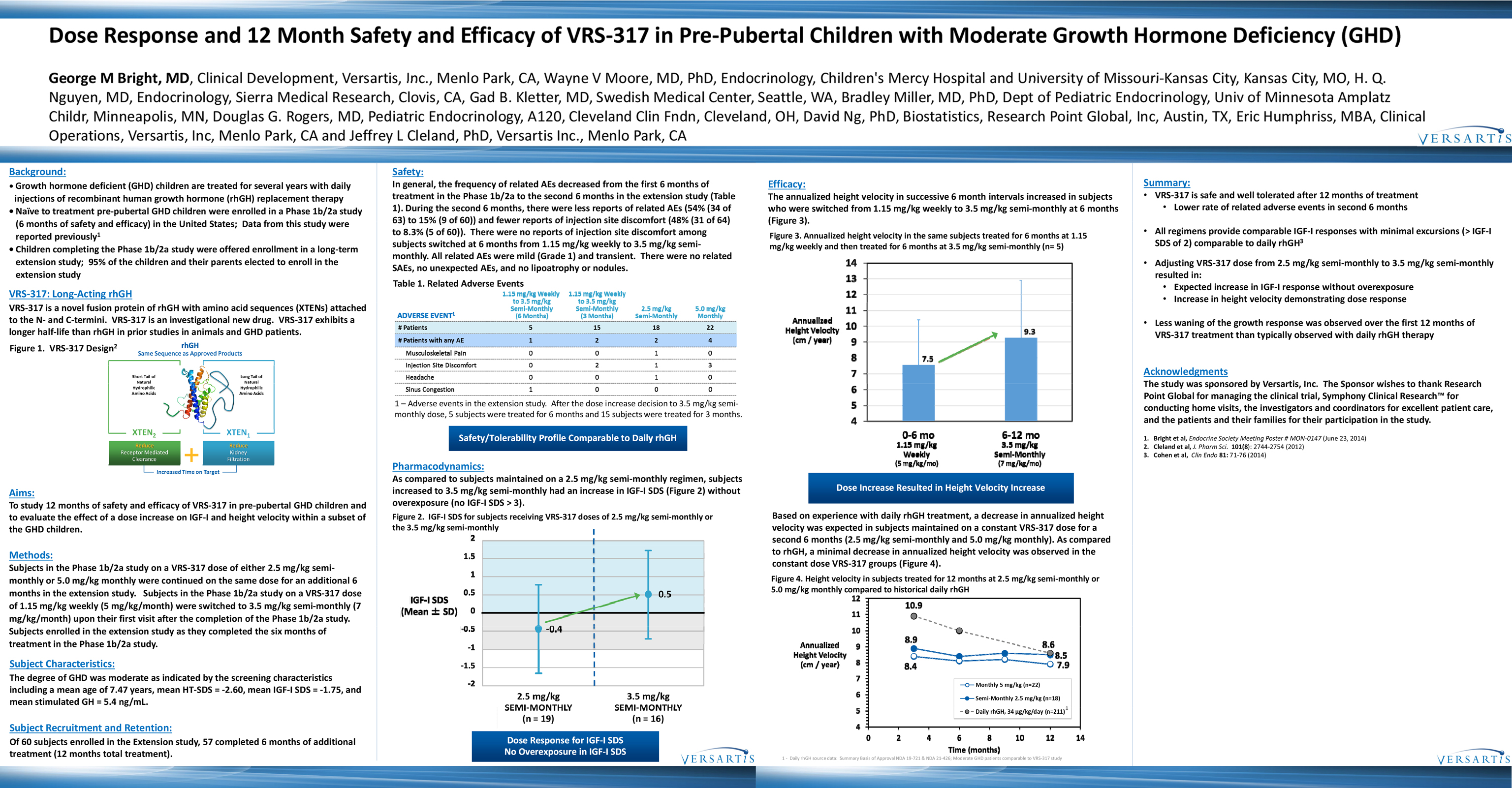
Dose Response and 12 Month Safety and Efficacy of VRS-317 in Pre-Pubertal Children with Moderate Growth Hormone Deficiency (GHD)
George M Bright, MD, Clinical Development, Versartis, Inc., Menlo Park, CA, Wayne V Moore, MD, PhD, Endocrinology, Children’s Mercy Hospital and University of Missouri-Kansas City, Kansas City, MO, H. Q. Nguyen, MD, Endocrinology, Sierra Medical Research, Clovis, CA, Gad B. Kletter, MD, Swedish Medical Center, Seattle, WA, Bradley Miller, MD, PhD, Dept of Pediatric Endocrinology, Univ of Minnesota Amplatz Childr, Minneapolis, MN, Douglas G. Rogers, MD, Pediatric Endocrinology, A120, Cleveland Clin Fndn, Cleveland, OH, David Ng, PhD, Biostatistics, Research Point Global, Inc, Austin, TX, Eric Humphriss, MBA, Clinical Operations, Versartis, Inc, Menlo Park, CA and Jeffrey L Cleland, PhD, Versartis Inc., Menlo Park, CA
Background:
Growth hormone deficient (GHD) children are treated for several years with daily injections of recombinant human growth hormone (rhGH) replacement therapy Naïve to treatment pre-pubertal GHD children were enrolled in a Phase 1b/2a study (6 months of safety and efficacy) in the United States; Data from this study were reported previously1
Children completing the Phase 1b/2a study were offered enrollment in a long-term extension study; 95% of the children and their parents elected to enroll in the extension study
VRS-317: Long-Acting rhGH
VRS-317 is a novel fusion protein of rhGH with amino acid sequences (XTENs) attached to the N-and C-termini. VRS-317 is an investigational new drug. VRS-317 exhibits a longer half-life than rhGH in prior studies in animals and GHD patients.
Figure 1. VRS-317 Design
Aims:
To study 12 months of safety and efficacy of VRS-317 in pre-pubertal GHD children and to evaluate the effect of a dose increase on IGF-I and height velocity within a subset of the GHD children.
Methods:
Subjects in the Phase 1b/2a study on a VRS-317 dose of either 2.5 mg/kg semi-monthly or 5.0 mg/kg monthly were continued on the same dose for an additional 6 months in the extension study. Subjects in the Phase 1b/2a study on a VRS-317 dose of 1.15 mg/kg weekly (5 mg/kg/month) were switched to 3.5 mg/kg semi-monthly (7 mg/kg/month) upon their first visit after the completion of the Phase 1b/2a study. Subjects enrolled in the extension study as they completed the six months of treatment in the Phase 1b/2a study.
Subject Characteristics:
The degree of GHD was moderate as indicated by the screening characteristics including a mean age of 7.47 years, mean HT-SDS = -2.60, mean IGF-I SDS = -1.75, and mean stimulated GH = 5.4 ng/mL.
Subject Recruitment and Retention:
Of 60 subjects enrolled in the Extension study, 57 completed 6 months of additional treatment (12 months total treatment).
Safety:
In general, the frequency of related AEs decreased from the first 6 months of treatment in the Phase 1b/2a to the second 6 months in the extension study (Table
1). During the second 6 months, there were less reports of related AEs (54% (34 of 63) to 15% (9 of 60)) and fewer reports of injection site discomfort (48% (31 of 64) to 8.3% (5 of 60)). There were no reports of injection site discomfort among subjects switched at 6 months from 1.15 mg/kg weekly to 3.5 mg/kg semi-monthly. All related AEs were mild (Grade 1) and transient. There were no related SAEs, no unexpected AEs, and no lipoatrophy or nodules.
Table 1. Related Adverse Events
ADVERSE EVENT 1
1.15 mg/kg Weekly to 3.5 mg/kg Semi-Monthly (6 Months)
1.15 mg/kg Weekly to 3.5 mg/kg Semi-Monthly (3 Months)
2.5 mg/kg Semi-Monthly
5.0 mg/kg Monthly
# Patients 5 15 18 22
# Patients with any AE 1 2 2 4
Musculoskeletal Pain 0 0 1 0
Injection Site Discomfort 0 2 1 3
Headache 0 0 1 0
Sinus Congestion 1 0 0 0
1 – Adverse events in the extension study. After the dose increase decision to 3.5 mg/kg semi-monthly dose, 5 subjects were treated for 6 months and 15 subjects were treated for 3 months.
Safety/Tolerability Profile Comparable to Daily rhGH
Pharmacodynamics:
As compared to subjects maintained on a 2.5 mg/kg semi-monthly regimen, subjects increased to 3.5 mg/kg semi-monthly had an increase in IGF-I SDS (Figure 2) without overexposure (no IGF-I SDS > 3).
Figure 2. IGF-I SDS for subjects receiving VRS-317 doses of 2.5 mg/kg semi-monthly or the 3.5 mg/kg semi-monthly
IGF-I SDS (MEAN SD)
2.5 mg/kg SEMI-MONTHLY (n=19)
3.5 mg/kg SEMI-MONTHLY (n=16)
-2 -1.5 -1 -0.5 0 0.5 1 1.5 2 -0.4 0.5
Dose Response for IGF-I SDS No Overexposure in IGF-I SDS
Efficacy:
The annualized height velocity in successive 6 month intervals increased in subjects who were switched from 1.15 mg/kg weekly to 3.5 mg/kg semi-monthly at 6 months (Figure 3).
Figure 3. Annualized height velocity in the same subjects treated for 6 months at 1.15 mg/kg weekly and then treated for 6 months at 3.5 mg/kg semi-monthly (n= 5)
Annualized Height Velocity (cm / year)
0-6 mo 1.15 mg/kg weekly (5mg/kg/mo)
6-12 mo 3.5 mg/kg Semi-Monthly (7mg/kg/mo)
| 4 |
|
5 6 7 8 9 10 11 12 13 14 7.5 9.3 |
Dose Increase Resulted in Height Velocity Increase
Based on experience with daily rhGH treatment, a decrease in annualized height velocity was expected in subjects maintained on a constant VRS-317 dose for a second 6 months (2.5 mg/kg semi-monthly and 5.0 mg/kg monthly). As compared to rhGH, a minimal decrease in annualized height velocity was observed in the constant dose VRS-317 groups (Figure 4).
Figure 4. Height velocity in subjects treated for 12 months at 2.5 mg/kg semi-monthly or 5.0 mg/kg monthly compared to historical daily rhGH
0 2 4 6 8 10 12 14
| 4 |
|
5 6 7 8 9 10 11 12 |
8.4 8.5 8.6 8.9 7.9 10.9
Monthly 5mg/kg (n=22)
Semi-Monthly 2.5 mg/kg (n=18)
Daily rhGH,34 g/kg/day (n=211)1
1 - Daily rhGH source data: Summary Basis of Approval NDA 19-721 & NDA 21-426; Moderate GHD patients comparable to VRS-317 study
Summary:
VRS-317 is safe and well tolerated after 12 months of treatment
Lower rate of related adverse events in second 6 months
All regimens provide comparable IGF-I responses with minimal excursions (> IGF-I SDS of 2) comparable to daily rhGH3
Adjusting VRS-317 dose from 2.5 mg/kg semi-monthly to 3.5 mg/kg semi-monthly resulted in:
Expected increase in IGF-I response without overexposure
Increase in height velocity demonstrating dose response
Less waning of the growth response was observed over the first 12 months of VRS-317 treatment than typically observed with daily rhGH therapy
Acknowledgments
The study was sponsored by Versartis, Inc. The Sponsor wishes to thank Research Point Global for managing the clinical trial, Symphony Clinical Research™ for conducting home visits, the investigators and coordinators for excellent patient care, and the patients and their families for their participation in the study.
1. Bright et al, Endocrine Society Meeting Poster # MON-0147 (June 23, 2014)
2. Cleland et al, J. Pharm Sci. 101(8): 2744-2754 (2012)
3. Cohen et al, Clin Endo 81: 71-76 (2014)